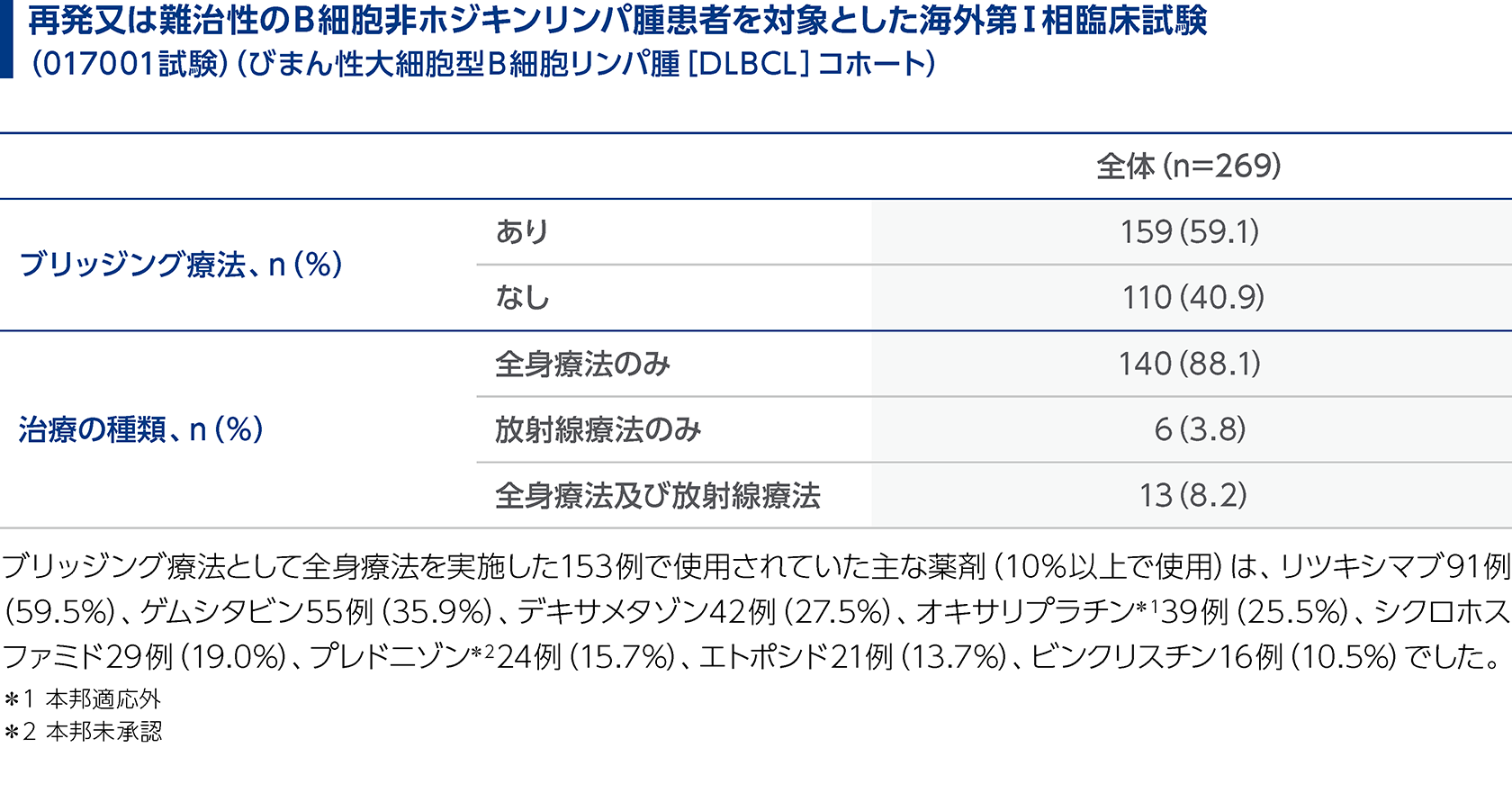
Breyanzi
製品情報:ブレヤンジ
ブレヤンジは、
白血球アフェレーシスにより採取された産物から精製された、患者自身のT細胞から作られます。

STEP01
白血球アフェレーシス
Apheresis
白血球アフェレーシスにより、T細胞を採取します。
24.0日 (範囲:17-51)
STEP02
製造
Manufacturing
白血球アフェレーシス産物はブレヤンジ製造施設に輸送され、精製・加工後、目標細胞数までCD8やCD4陽性CAR発現生T細胞を増殖します。
37.0日 (範囲:27-224)
STEP03
投与
Administration
リンパ球除去化学療法(LDC)(フルダラビン及びシクロホスファミドを3日間投与)終了後2~7日以内にブレヤンジを投与します。ブレヤンジの医療施設受領日を考慮し、LDCを実施します。
STEP04
観察
Symptom monitoring
投与後は適切なモニタリング及び経過観察を行ってください。
STEP01
Apheresis
白血球アフェレーシス/臨床試験における
薬剤等の禁止期間
白血球アフェレーシス
本品は患者のT細胞より製造するCAR T細胞療法製品であるため、白血球アフェレーシスを行
います。
白血球アフェレーシスの準備
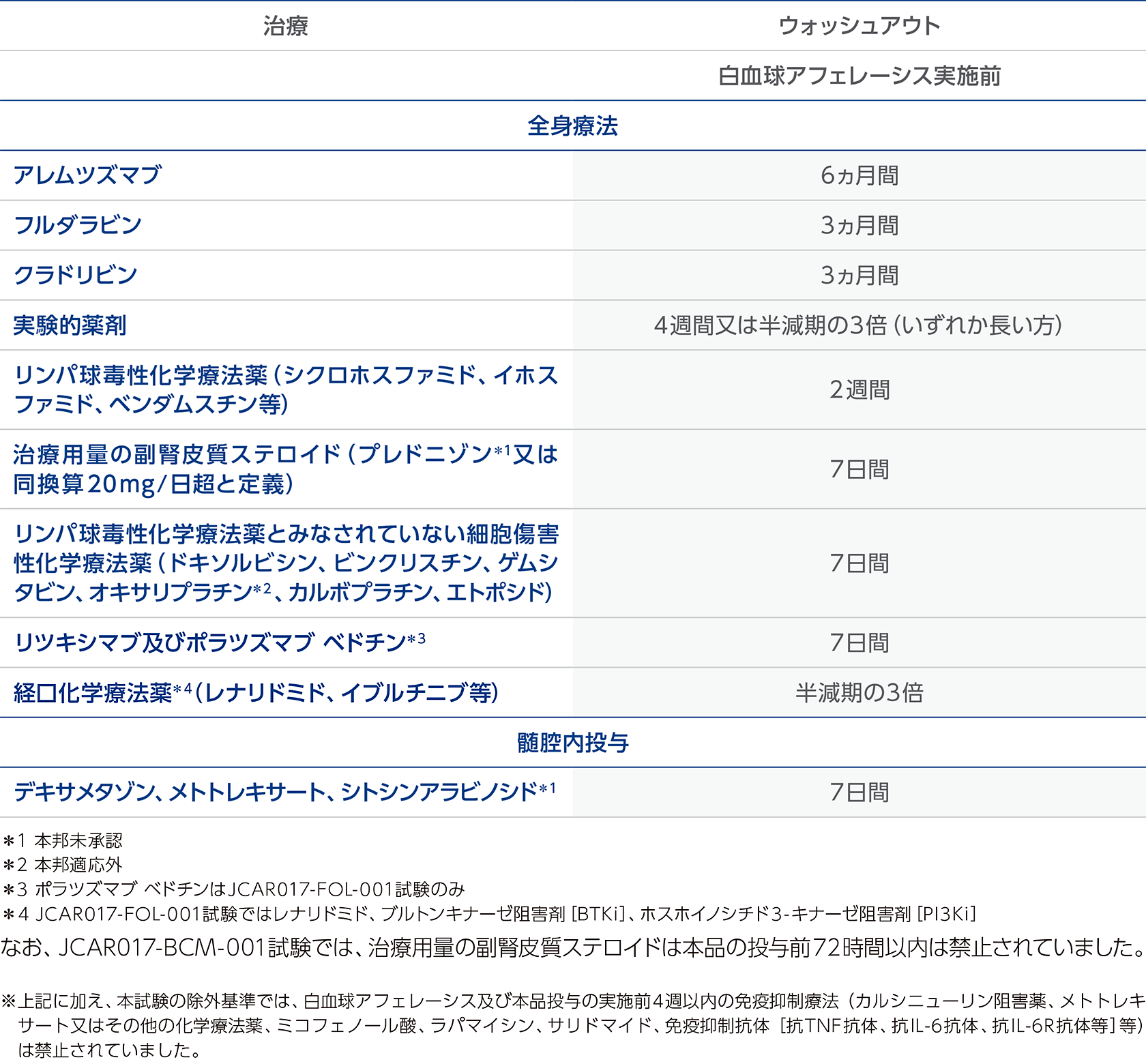
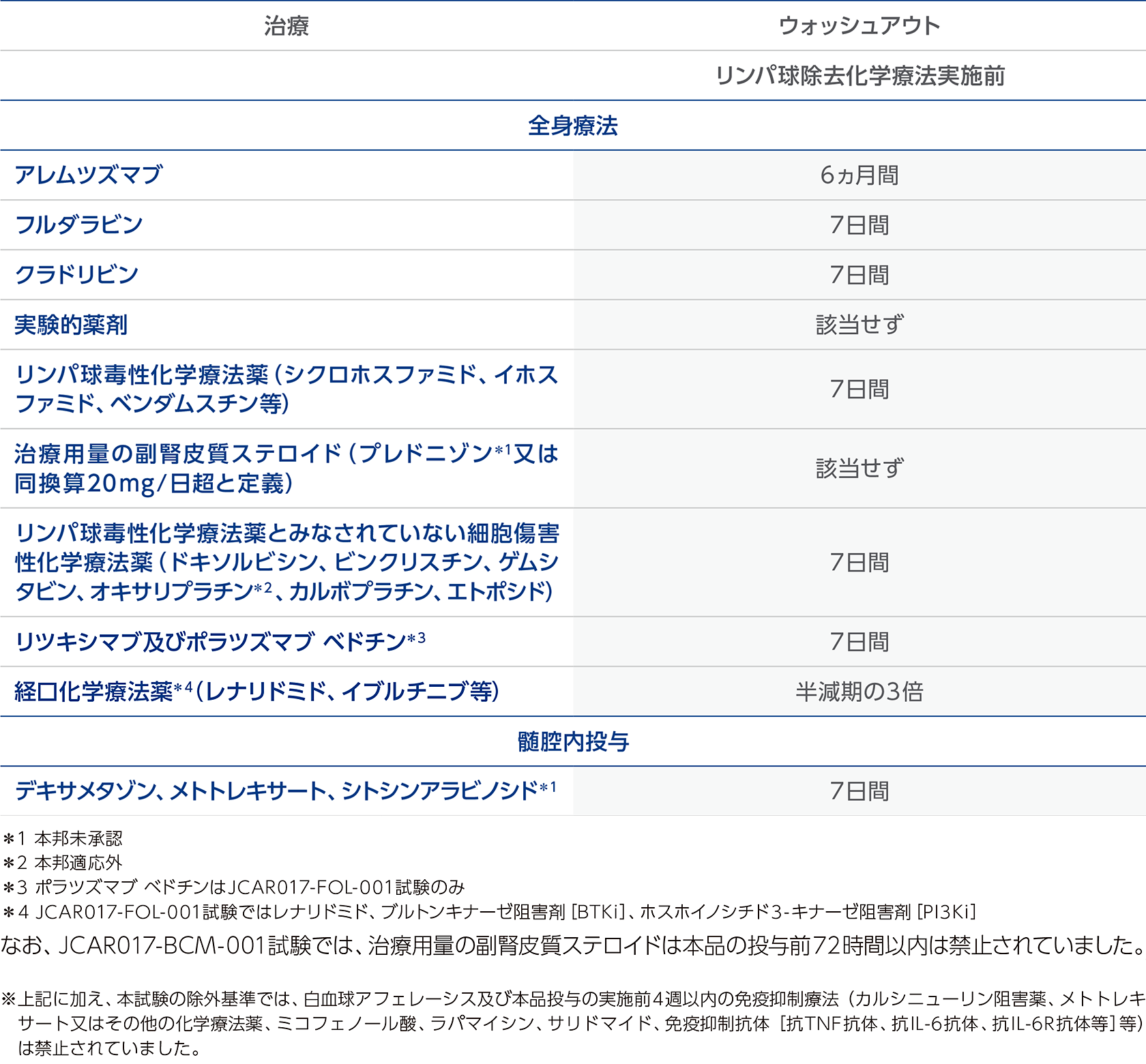
一次治療後に再発又は難治性の自家造血幹細胞移植適応のアグレッシブB細胞非ホジキンリンパ腫患者を対象とした国際共同第Ⅲ相臨床試験(JCAR017-BCM-003試験)、再発又は難治性のアグレッシブB細胞非ホジキンリンパ腫患者を対象とした国際共同第Ⅱ相臨床試験(JCAR017-BCM-001試験)及び再発又は難治性の濾胞性リンパ腫(Grade 1、2、3A)を対象とした国際共同第Ⅱ相臨床試験(JCAR017-FOL-001試験)では、白血球アフェレーシス実施前及びリンパ球除去化学療法実施前に、下表のとおり、薬剤の使用禁止期間(ウォッシュアウト期間)を定めていました。治療施設と紹介元施設が連携し、ウォッシュアウトが必要な治療を中止してください。
白血球アフェレーシス実施前のウォッシュアウト期間
白血球アフェレーシスの実施に際して、ウォッシュアウト期間が必要な治療があります。治療施設と紹介元施設が連携し、ウォッシュアウトが必要な治療を中止してください。
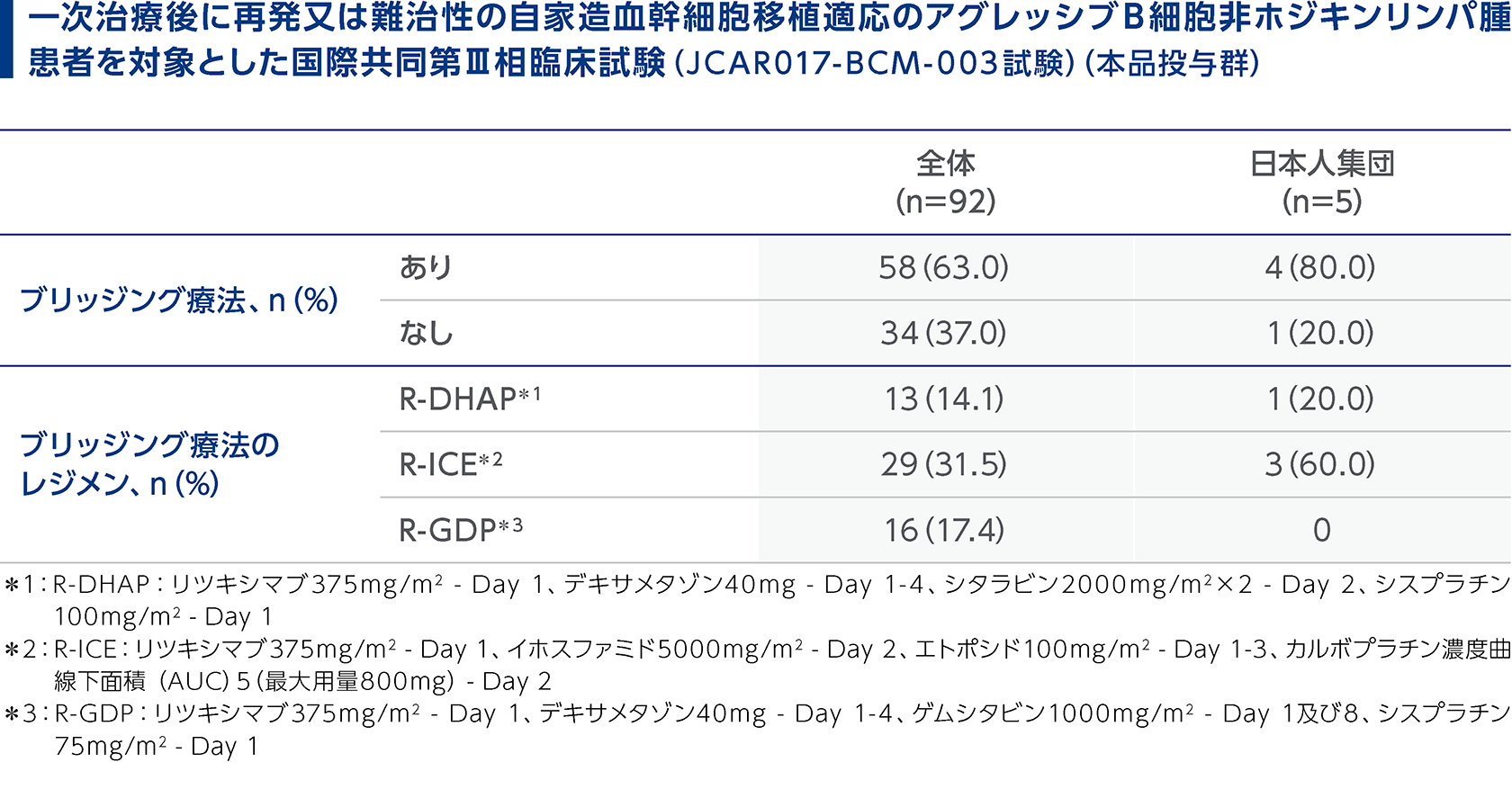
一次治療後に再発又は難治性の自家造血幹細胞移植適応のアグレッシブB細胞非ホジキンリンパ腫患者を対象とした国際共同第Ⅲ相臨床試験(JCAR017-BCM-003試験)
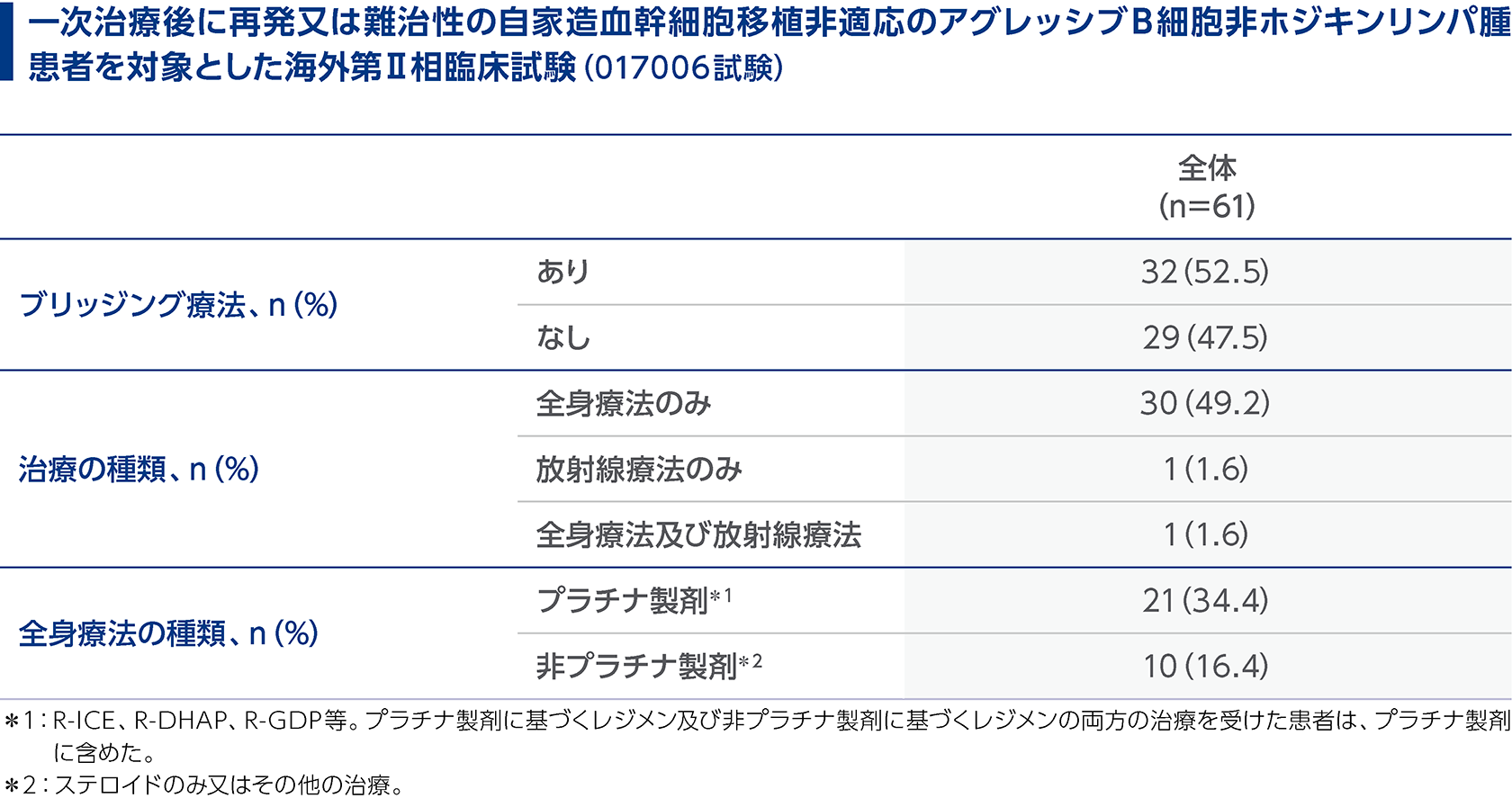
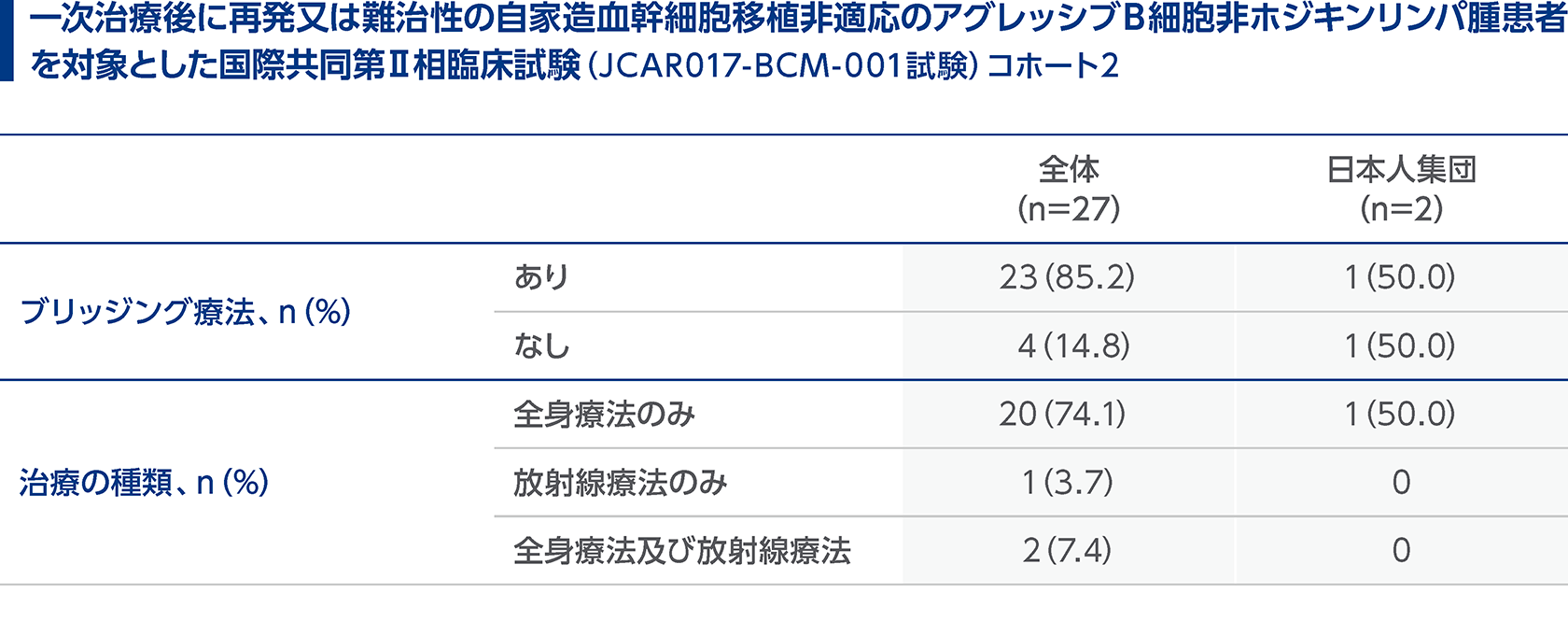
再発又は難治性のアグレッシブB細胞非ホジキンリンパ腫患者を対象とした国際共同第Ⅱ相臨床試験(JCAR017-BCM-001試験)及び再発又は難治性の濾胞性リンパ腫(Grade 1、2、3A)を対象とした国際共同第Ⅱ相臨床試験(JCAR017-FOL-001試験)
ブリッジング療法を
適宜実施します
Bridging therapy
ブリッジング療法
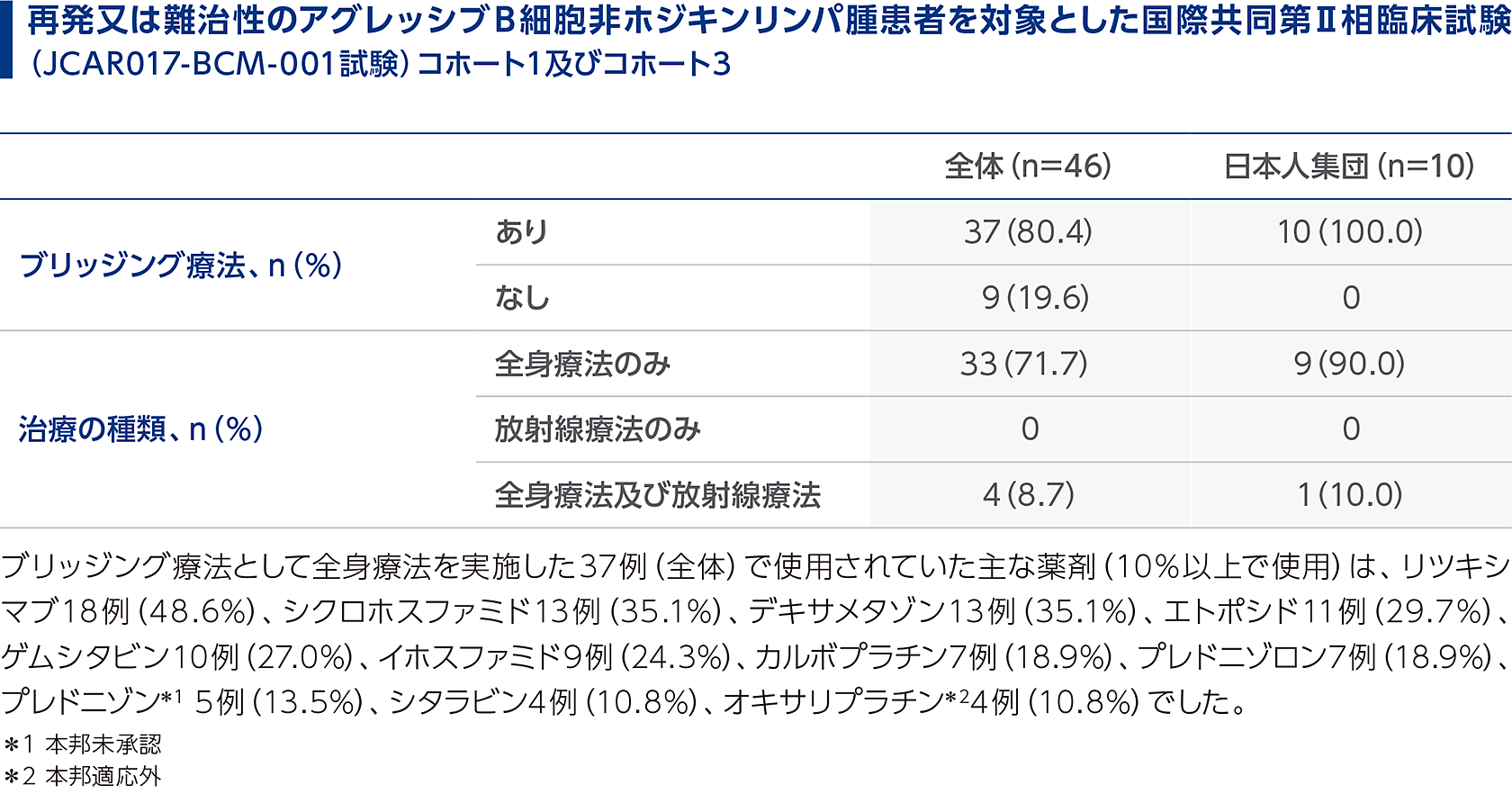
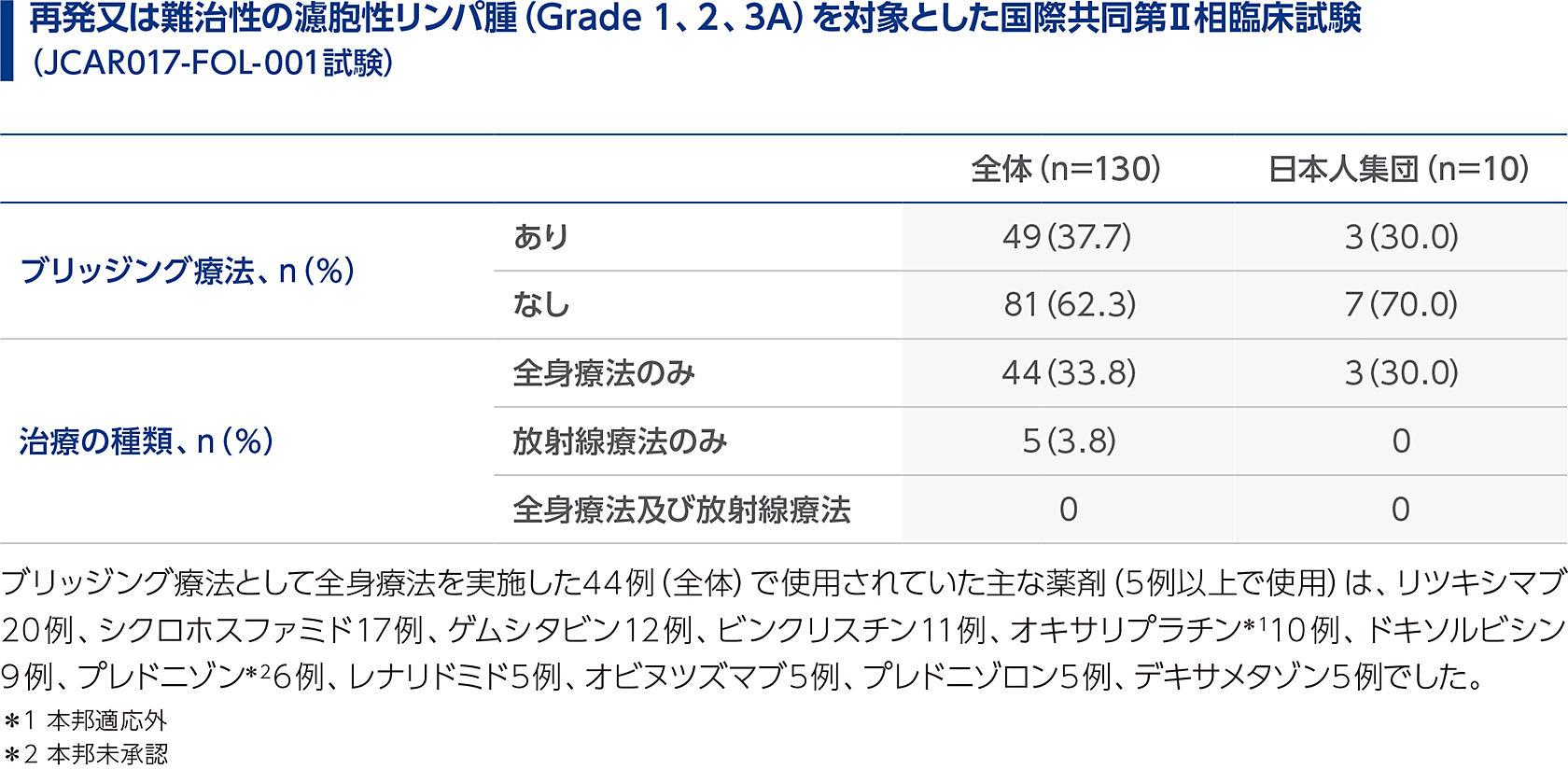
白血球アフェレーシス後からリンパ球除去化学療法の開始前までの病勢コントロールを目的に、患者の腫瘍量等に応じて、抗腫瘍療法(ブリッジング療法)を適宜実施してください。 本品の臨床試験でリンパ球除去化学療法の開始前までの病勢コントロールを目的にブリッジング療法を施行した患者の割合は以下のとおりでした。
STEP02
lymphodepletion
リンパ球除去化学療法
リンパ球除去化学療法実施前のウォッシュアウト期間
リンパ球除去化学療法の実施に際して、ウォッシュアウト期間が必要な治療があります。治療施設と紹介元施設が連携し、ウォッシュアウトが必要な治療を中止してください。
再発又は難治性のアグレッシブB細胞非ホジキンリンパ腫患者を対象とした国際共同第Ⅱ相臨床試験(JCAR017-BCM-001試験)及び再発又は難治性の濾胞性リンパ腫(Grade 1、2、3A)を対象とした国際共同第Ⅱ相臨床試験(JCAR017-FOL-001試験)
本品投与前の前処置として、本品投与の2日前から7日前までに以下のリンパ球除去化学療法を行ってください。
なお、以下のいずれかの状態が患者に認められた場合には、回復するまでリンパ球除去化学療法を延期してください。
- 先行する化学療法に起因する事象を含む重篤な有害事象(肺障害、心障害、低血圧等)の持続
- コントロール不良な活動性の感染症、炎症性疾患
- 活動性の移植片対宿主病(GVHD)
リンパ球除去化学療法の薬剤・スケジュール
① フルダラビンリン酸エステルとして30mg/m²を1日1回3日間点滴静注及びシクロホスファミド(無水物換算)として300mg/m²を1日1回3日間点滴静注する。なお、患者の状態(腎機能障害等)により適宜減量する*。

*本品の臨床試験でのリンパ球除去化学療法は、以下のとおり規定されていました。腎機能障害によるフルダラビンリン酸エステルの減量は、以下のとおり実施してください。
リンパ球除去化学療法の初日に血清クレアチニンを測定する。血清クレアチニンが正常値上限(ULN)の1.5倍超、あるいは推算クレアチニンクリアランス(Cockcroft-Gault式による)又は放射性同位体糸球体ろ過量(GFR)が30mL/min未満の場合、リンパ球除去化学療法を中止する。
推奨される投与方法は以下のとおり。
- シクロホスファミドの投与2時間前に、0.9%生理食塩液1 Lを500 mL/hrの投与速度で静脈内投与する。
- フルダラビンリン酸エステル30mg/m2を30 分かけて静脈内投与する。
- クレアチニンクリアランスが50~70 mL/minの場合:用量を毎回の1日投与量から20%減量する。
- クレアチニンクリアランスが30~49 mL/minの場合:用量を毎回の1日投与量から40%減量する。
- クレアチニンクリアランスが30 mL/min未満の場合:フルダラビンリン酸エステルの投与を中止する。
- シクロホスファミド300 mg/m²を60分かけて静脈内投与する。
- 0.9%生理食塩液1 Lを500 mL/hrの投与速度で追加投与する。
② リンパ球除去化学療法終了2~7日後に本品を投与する*。
*本品の臨床試験では、リンパ球除去化学療法による副作用が発現した場合、治験依頼者との協議に基づき、本品の投与をリンパ球除去化学療法の終了から14日後まで延期することが許容されていました。
STEP03
Administration
follow up
ブレヤンジの投与/
投与後のフォローアップ
本品投与後は、副作用が高頻度に発現することが報告されています。そのため、以下のいずれかの状態が患者に認められた場合には、回復するまで本品の投与を延期してください。
- 先行する化学療法に起因する事象を含む重篤な有害事象(肺障害、心障害、低血圧等)の持続
- コントロール不良な活動性の感染症、炎症性疾患
- 活動性の移植片対宿主病(GVHD)
本品の投与約30~60分前に、infusion reactionのリスクを抑えるため、アセトアミノフェン及びジフェンヒドラミン又はその他のヒスタミンH1受容体拮抗薬を投与してください。なお、生命を脅かす緊急時を除き、副腎皮質ステロイド剤は使用しないでください。アナフィラキシー等の投与に伴う重度の事象が発現した場合に備え、救急措置の準備をしてください。本品の臨床試験では、注入反応への対応として、以下のガイドラインに従うこととしていました。
対処法
サイトカイン放出症候群があらわれることがあるので、緊急時に備えて、本品投与前に2回分以上のトシリズマブ(遺伝子組換え)の在庫を確保し、速やかに使用できるように準備してください。また、緊急時にはICU等を利用できる体制を整えてください。
投与後の注意事項
- 投与後に注意を要する副作用については、サイトカイン放出症候群、神経系事象、感染症、血球減少、低γグロブリン血症、Infusion reaction、腫瘍崩壊症候群があり、詳細は適正使用ガイドを参照してください。
- 本品投与後にサイトカイン放出症候群及び神経系事象に関連した徴候及び症状があらわれることがあるため、投与後は、入院管理下で綿密なモニタリングを行ってください。
- 本品投与後少なくとも4週間は、サイトカイン放出症候群や神経系事象の徴候及び症状に注意し、異常が認められた場合は、速やかに適切な医療機関で診察を受けるよう患者に指示してください。
- 精神状態変化や痙攣発作等の神経系事象があらわれることがあるので、本品投与後一定期間は、自動車運転や危険を伴う機械の操作に従事させないよう指導してください。
- -本品の臨床試験で認められた「治験責任医師によって特定された神経系事象」の初回発現の範囲は、全Gradeで本品投与後1~66日(2例を除き、50日目までに発現)、Grade 3以上で本品投与後2~44日でした。
本品の米国添付文書では、本品投与後少なくとも8週間は自動車運転や危険を伴う機械の操作に従事させないよう指導することが推奨されています。 - 本品の製造に使用されるレンチウイルスベクターにはHIV-1の遺伝子配列(RNA)が一部含まれるため、HIV核酸増幅検査(NAT)で偽陽性になるおそれがあります。
- 本品による治療を受けた患者は、移植のために血液、臓器、組織及び細胞を提供しないよう指導してください。
- 臨床試験において、本品投与後に悪性腫瘍の発現が報告されています。本品の投与後は長期間経過を観察してください。